免疫组化是应用免疫学基本原理-抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的研究。
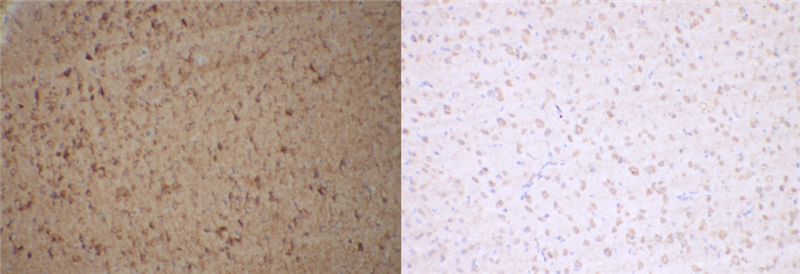
然而理想是丰满的,实际操作起来却是骨感的,作为一种分析方法,常常会存在非特异着色的背景问题。下图中靶点均为胞膜定位,左边背景着色严重,右边染色效果优良。
菲恩生物自主开发几千种抗体,积累了丰富的抗体检测经验,经过上万次切片检测,从中摸索和总结出造成非特异着色的几大主要因素。
1.抗体质量问题
抗体本身在靶点设计上如果特异性不够,会导致非特异着色。一般来说,单抗在特异性上相比多抗是具有优势的,但多抗由于识别任一抗原上的多个表位,多抗可放大低表达水平靶蛋白的信号,对微小抗原变化(例如多态性、糖基化异质性或者轻微变性)的包容性更强,可用于非免疫原物种的靶蛋白的检测实验。具体实验时,还应根据实际需要选择合适的抗体。另外,抗体保存也应注意防腐及防止反复冻融。
2.内源性酶和生物素
当选用肝、肾,脾组织作为样本时,由于这些组织本身含有较高含量的过氧化酶和生物素,对于使用Hrp或生物素-亲和素显色系统的实验都会造成非特异性染色。对于内源性过氧化物酶,可以用0.9%的双氧水来灭活。对于内源性生物素,染色前将切片浸于25 μg/mL亲和素溶液中15分钟,PBS清洗15分钟后即可染色。也可以24 mg/mL的卵白素封片15分钟。
3.抗体浓度过高
为了获得良好的染色结果,一般应优化一抗的使用浓度,可参考供应商提供的说明书,但预实验也是必不可少的,摸索出最理想的工作浓度。
4.DAB染色时间太长/变质
DAB的作用时间过长,同样会造成背景。DAB的显色时间不是一成不变的,实验时应及时镜检,出现浅棕色时,马上冲洗。出现棕色的时间过短,表明抗体浓度过高;出现棕色的时间过长,表明抗体有效浓度过低。DAB要保存于避光干燥的地方,现用现配,临用前才加入H2O2。
5.组织变干
另外,整个实验过程中应保持样本表面和外围湿润,避免因试剂流失导致背景的产生。显色时,一次不要同时染过多张片子,可分批显色。
6.浸泡时间过长
切片应避免在缓冲液或修复液里面浸泡过夜,整个实验过程应是连贯的,减少非必要程序和未知因素干扰。
7.清洗不充分
抗体孵育后的清洗应充分,PBS使用前应确定pH值,必要时可添加Tween-20增加洗涤强度。
8.封闭问题
免疫组化一般使用血清稀释液进行封闭,为排除二抗本身造成的非特异吸附,可使用二抗动物的非免疫血清,例如二抗是羊抗兔,就要选择非免疫羊血清。用PBS稀释为3-10%的溶液孵育切片,37°C 10-30分钟,封闭后不用清洗,直接甩掉即可。另外组织固定后可能会残留部分游离醛基,在孵育抗体过程中也可能产生非特异结合,此时可使用0.3M 甘氨酸进行封闭。
以上就是免疫组化实验中常见的背景着色的原因,希望对大家的实验结果改进有帮助。